耳たこ無機化学の「金属イオンのまとめ」の暗記ページです。
[ ] や表の空欄をクリックすると答えが表示されます。
また、ページをリロード(再読み込み)またはページを移動すると再度空欄になるので、何度も繰り返して暗記していきましょう!
金属イオンの反応
塩基との沈殿
NaOH水溶液
アンモニア水
過剰
少量
過剰
Ag⁺
Ag₂O
[ 色・状態 ]
[ 色・状態 ]
[Ag(NH₃)₂]⁺
[ 色・状態 ]
[ 色・状態 ]
Cu²⁺
Cu(OH)₂
[ 色・状態 ]
[ 色・状態 ]
[Cu(NH₃)₄]²⁺
[ 色・状態 ]
[ 色・状態 ]
Pb²⁺
[ 色・状態 ]
Pb(OH)₂
[ 色・状態 ]
[ 色・状態 ]
Fe²⁺
Fe(OH)₂
[ 色・状態 ]
[ 色・状態 ]
Fe³⁺
e(OH)₃
[ 色・状態 ]
[ 色・状態 ]
Zn²⁺
[Zn(OH)₄]²⁻
[ 色・状態 ]
[ 色・状態 ]
Zn(OH)₂
[ 色・状態 ]
[ 色・状態 ]
[Zn(NH₃)₄]²⁺
[ 色・状態 ]
[ 色・状態 ]
Al³⁺
[Al(OH)₄]⁻
[ 色・状態 ]
[ 色・状態 ]
Al(OH)₃
[ 色・状態 ]
[ 色・状態 ]
硫化水素・塩酸との沈殿
硫化水素 H₂S
塩酸
酸性
中性・塩基性
HCl
Ag⁺
Ag₂S [ 色・状態 ]
AgCl
[ 色・状態 ]
Hg²⁺
HgS [ 色・状態 ]
–
Cu²⁺
CuS [ 色・状態 ]
×
Pb²⁺
PbS [ 色・状態 ]
PbCl₂
[ 色・状態 ]
Cd²⁺
CdS [ 色・状態 ]
–
Ni²⁺
×
NiS [ 色・状態 ]
–
Fe²⁺
×
FeS [ 色・状態 ]
×
Fe³⁺
–
FeS [ 色・状態 ]
×
Zn²⁺
×
ZnS [ 色・状態 ]
×
Mn²⁺
×
MnS [ 色・状態 ]
–
硫酸・炭酸・クロム酸との沈殿
硫酸 SO₄²⁻
炭酸 CO₃²⁻
クロム酸 CrO₄²⁻
Ag⁺
×
–
Ag₂CrO₄ [ 色・状態 ]
Pb²⁺
PbSO₄ [ 色・状態 ]
–
PbCrO₄ [ 色・状態 ]
Ca²⁺
CaSO₄ [ 色・状態 ]
CaCO₃ [ 色・状態 ]
×
Ba²⁺
BaSO₄ [ 色・状態 ]
BaCO₃ [ 色・状態 ]
BaCrO₄ [ 色・状態 ]
炎色反応
Li⁺
[ 炎色反応 ]
Ca²⁺
[ 炎色反応 ]
Na⁺
[ 炎色反応 ]
Sr²⁺
[ 炎色反応 ]
K⁺
[ 炎色反応 ]
Ba²⁺
[ 炎色反応 ]
Cu²⁺
[ 炎色反応 ]
金属イオンの分類
系統分離
複数の金属イオン Na⁺、Ca²⁺、Al³⁺、Fe³⁺、Zn²⁺、Pb²⁺、Cu²⁺、Ag⁺ が混ざった水溶液から各金属イオンを分離する手順は次のようになる。
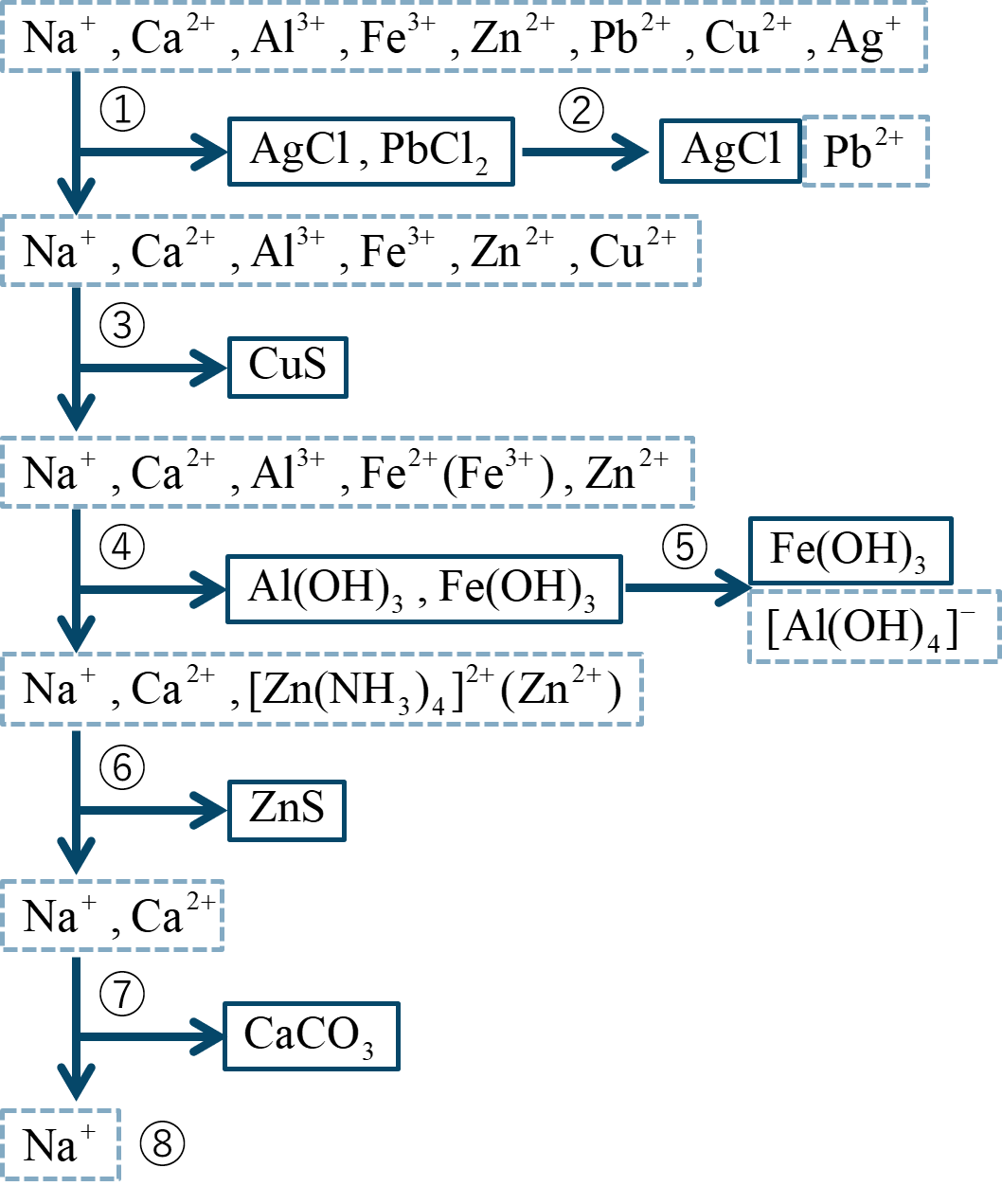
① [ 物質名(酸) ] を加えると、[ 色 ] の [ 化合物 ] と [ 色 ] の [ 化合物 ] が沈殿する。
→ Pb²⁺、Ag⁺ を分離
→ Pb²⁺、Ag⁺ を分離
② [ 物体 ] を加えると、[ 化合物 ] は溶けて [ 色・状態 ] となる。
→ Pb²⁺ と Ag⁺ を区別
→ Pb²⁺ と Ag⁺ を区別
③ [ 液性 ] 溶液中で [ 化合物 ] H₂S を通じると、[ 色 ] の [ 化合物 ] が沈殿する。
→ Fe³⁺ が Fe²⁺ として、Cu²⁺ を分離
→ Fe³⁺ が Fe²⁺ として、Cu²⁺ を分離
④ [ 用語 ] して [ 化合物 ] を蒸発させる。
[ 物質名(酸) ] を加えて Fe²⁺ → Fe³⁺ とする。
[ 物質名 ] を加えると、[ 色 ] の [ 化合物 ] と [ 色 ] の [ 化合物 ] が沈殿する。
→ Al³⁺、Fe³⁺ を分離
[ 物質名(酸) ] を加えて Fe²⁺ → Fe³⁺ とする。
[ 物質名 ] を加えると、[ 色 ] の [ 化合物 ] と [ 色 ] の [ 化合物 ] が沈殿する。
→ Al³⁺、Fe³⁺ を分離
⑤ [ 量 ] に [ 化合物 ] 水溶液を加えると、[ 化合物 ] が溶けて [ 色・状態 ] となる。
→ Al³⁺ と Fe³⁺ を区別
→ Al³⁺ と Fe³⁺ を区別
⑥ [ 液性 ] 溶液中で [ 化合物 ] H₂S を通じると、[ 色 ] の [ 化合物 ] が沈殿する。
→ Zn²⁺ を分離
→ Zn²⁺ を分離
⑦ [ 用語 ] して [ 化合物 ] を蒸発させる。
[ 化合物 ] (NH₄)₂CO₃ を加えると、[ 色 ] の [ 化合物 ] が沈殿する。
→ Ca²⁺ を分離
[ 化合物 ] (NH₄)₂CO₃ を加えると、[ 色 ] の [ 化合物 ] が沈殿する。
→ Ca²⁺ を分離
⑧ 残った [ 用語 ] は [ 反応 ] で調べる。
→ Na⁺ を確認 [ 炎色反応 ]
→ Na⁺ を確認 [ 炎色反応 ]
これらのイオンの代わりに、
Cu²⁺ → Hg²⁺やCd²⁺、Zn²⁺ → Ni²⁺やMn²⁺、
Ca²⁺ → Sr²⁺やBa²⁺、Na⁺ → K⁺
これらを用いることがある。
Cu²⁺ → Hg²⁺やCd²⁺、Zn²⁺ → Ni²⁺やMn²⁺、
Ca²⁺ → Sr²⁺やBa²⁺、Na⁺ → K⁺
これらを用いることがある。

無機化学分野単元一覧
このページは「無機化学分野単元一覧ページ」です。
下の一覧表のリンクをクリックして、各単元のページ...


