耳たこ無機化学の「アルカリ金属」の暗記ページです。
[ ] や表の空欄をクリックすると答えが表示されます。
また、ページをリロード(再読み込み)またはページを移動すると再度空欄になるので、何度も繰り返して暗記していきましょう!
アルカリ金属
アルカリ金属の性質
[ 物質名 ] を除く [ 族 ] の [ 金属 ] Li、[ 金属 ] Na、[ 金属 ] K、[ 金属 ] Rb、[ 金属 ] Csを [ 分類名 ] という。
■ アルカリ金属の性質
① [ 用語 ] が [ 大小 ] 、[ 価数・イオン ] になる。
② 単体は [ 色 ] の [ 硬度 ]。[ 金属分類名 ] と分類され、[ 用語 ] が低い。
③ [ 用語 ] しやすいので [ 物体 ] 中に保存。
④ [ 反応 ] を示す。リチウムは [ 炎色 ]、ナトリウムは [ 炎色 ]、カリウムは [ 炎色 ] 。
□ アルカリ金属の製法
単体は、 [ ◯◯物 ] ( 塩化ナトリウム NaCl など ) の [ 別名 ] で得られる。
□ アルカリ金属の反応
[ ○○性 ] や [ ○○性 ] が大きい。水と激しく反応して、[ 単体 ] を発生し [ 用語 ] となる。
■ アルカリ金属の水酸化物
② 単体は [ 色 ] の [ 硬度 ]。[ 金属分類名 ] と分類され、[ 用語 ] が低い。
③ [ 用語 ] しやすいので [ 物体 ] 中に保存。
④ [ 反応 ] を示す。リチウムは [ 炎色 ]、ナトリウムは [ 炎色 ]、カリウムは [ 炎色 ] 。
□ アルカリ金属の製法
単体は、 [ ◯◯物 ] ( 塩化ナトリウム NaCl など ) の [ 別名 ] で得られる。
□ アルカリ金属の反応
[ ○○性 ] や [ ○○性 ] が大きい。水と激しく反応して、[ 単体 ] を発生し [ 用語 ] となる。
■ アルカリ金属の水酸化物
水酸化物の [ 水酸化物 ] [ 化学式 ]、[ 水酸化物 ] [ 化学式 ]、[ 水酸化物 ] [ 化学式 ] は [ 単体 ] に溶けて、1価の [ 液性 ] を示す。
ナトリウムの化合物
■ 水酸化ナトリウムの性質
[ 水酸化物 ] [ 化学式 ] の性質は、
① [ 色・状態 ] で、水に [ 溶けやすさ ] て、[ 液性・強弱 ] 性を示す。
② [ 用語 ] を [ 用語 ] する [ ○○性 ] がある。
③ [ 物質名 ] と反応して [ 物質名 ] となる。
(式) 2NaOH + CO₂ → Na₂CO₃ + H₂O
□ 水酸化ナトリウムの製法
工業的製法は、[ 物質名 ] 水溶液の [ 用語 ] で得られる。
(式) 2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂
① [ 色・状態 ] で、水に [ 溶けやすさ ] て、[ 液性・強弱 ] 性を示す。
② [ 用語 ] を [ 用語 ] する [ ○○性 ] がある。
③ [ 物質名 ] と反応して [ 物質名 ] となる。
(式) 2NaOH + CO₂ → Na₂CO₃ + H₂O
□ 水酸化ナトリウムの製法
工業的製法は、[ 物質名 ] 水溶液の [ 用語 ] で得られる。
(式) 2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂
■ 炭酸ナトリウムの性質
[ 水酸化物 ] [ 化学式 ] の性質は、
① [ 色・状態 ] で、水に [ 溶けやすさ ] て、塩は [ 液性 ] 性を示す。
② [ 用語 ] Na₂CO₃・10H₂O は空気中で [ 用語 ] する。
③ [ 物体 ] や [ 物体 ] の製造に用いる。
④ [ 液性 ] の物質と反応して [ 物質名 ] を発生する。
(式) Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂
□ 炭酸ナトリウムの製法
工業的製法は、[ 名称 ] 法で得られる。
① [ 色・状態 ] で、水に [ 溶けやすさ ] て、塩は [ 液性 ] 性を示す。
② [ 用語 ] Na₂CO₃・10H₂O は空気中で [ 用語 ] する。
③ [ 物体 ] や [ 物体 ] の製造に用いる。
④ [ 液性 ] の物質と反応して [ 物質名 ] を発生する。
(式) Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂
□ 炭酸ナトリウムの製法
工業的製法は、[ 名称 ] 法で得られる。
■ 炭酸水素ナトリウムの性質
[ 水酸化物 ] [ 化学式 ] の性質は、
① 白色の粉末で、水に [ 溶けやすさ ] て、塩は [ 液性 ] 性を示す。
② 胃の [ 物体 ] や [ 物体 ] に用いる。
③ [ 液性 ] の物質と反応して [ 物質名 ] を発生する。
(式) NaHCO₃ + HCl → NaCl + H₂O + CO₂
④ [ 用語 ] して [ 物質名 ] となり、[ 物質名 ] を発生する。
(式) 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
① 白色の粉末で、水に [ 溶けやすさ ] て、塩は [ 液性 ] 性を示す。
② 胃の [ 物体 ] や [ 物体 ] に用いる。
③ [ 液性 ] の物質と反応して [ 物質名 ] を発生する。
(式) NaHCO₃ + HCl → NaCl + H₂O + CO₂
④ [ 用語 ] して [ 物質名 ] となり、[ 物質名 ] を発生する。
(式) 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
アンモニアソーダ法
[ 化合物 ] の工業的製法を、[ 名称 ] 法、別名 [ 名称 ] 法という。
原料として [ 化合物 ] と [ 化合物 ] を用いて、副生成物として [ 化合物 ] を得る。
また、②と⑤の反応で得られた [ 化合物 ] 、[ 物質名 ] 、[ 化合物 ] は回収され①の反応で [ 用語 ] される。
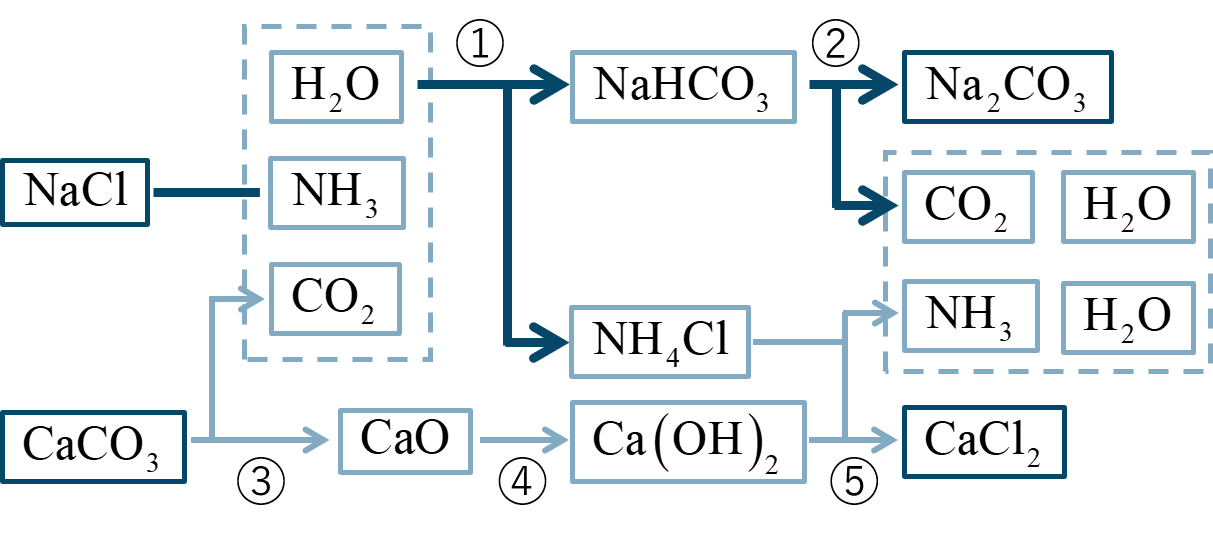
原料として [ 化合物 ] と [ 化合物 ] を用いて、副生成物として [ 化合物 ] を得る。
また、②と⑤の反応で得られた [ 化合物 ] 、[ 物質名 ] 、[ 化合物 ] は回収され①の反応で [ 用語 ] される。

① 主反応
[ 物体 ] に、十分な [ 化合物 ] を加えて [ 化合物 ] を通じる。
(式) NaCl + NH₃ + CO₂ + H₂O
→ NaHCO₃ + NH₄Cl
② 主反応
[ 化合物 ] を [ 用語 ] する。
(式) 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
③ 副反応
[ 物質名 ] = [ 化合物 ] を [ 用語 ] する。
(式) CaCO₃ → CaO + CO₂
④ 副反応
[ 物質名 ] = [ 化合物 ] に [ 物質名 ] を加える。
(式) CaO + H₂O → Ca(OH)₂
⑤ 副反応
[ 化合物 ] に [ 物質名 ] = [ 化合物 ] を加えて [ 化合物 ] を [ 用語 ] させる。
(式) 2NH₄Cl + Ca(OH)₂
→ CaCl₂ + 2NH₃ + 2H₂O
全体反応
2 mol の [ 化合物 ] に対して、1 mol の [ 化合物 ] が得られる。
(式) 2NaCl + CaCO₃ → Na₂CO₃ + CaCl₂
[ 物体 ] に、十分な [ 化合物 ] を加えて [ 化合物 ] を通じる。
(式) NaCl + NH₃ + CO₂ + H₂O
→ NaHCO₃ + NH₄Cl
② 主反応
[ 化合物 ] を [ 用語 ] する。
(式) 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
③ 副反応
[ 物質名 ] = [ 化合物 ] を [ 用語 ] する。
(式) CaCO₃ → CaO + CO₂
④ 副反応
[ 物質名 ] = [ 化合物 ] に [ 物質名 ] を加える。
(式) CaO + H₂O → Ca(OH)₂
⑤ 副反応
[ 化合物 ] に [ 物質名 ] = [ 化合物 ] を加えて [ 化合物 ] を [ 用語 ] させる。
(式) 2NH₄Cl + Ca(OH)₂
→ CaCl₂ + 2NH₃ + 2H₂O
全体反応
2 mol の [ 化合物 ] に対して、1 mol の [ 化合物 ] が得られる。
(式) 2NaCl + CaCO₃ → Na₂CO₃ + CaCl₂

無機化学分野単元一覧
このページは「無機化学分野単元一覧ページ」です。
下の一覧表のリンクをクリックして、各単元のページ...


