- 耳たこ無機化学「金属イオンのまとめ」の暗記ページです。
- 四角い枠をクリックすると解答が表示され、下のボタンで一括表示・非表示の切替ができます。
- 耳たこ音読では音声ファイルを再生して要点を音読します。通学時間などのスキマ学習に最適です。
- 目次をクリックすると各セクションへ移動します。
金属イオンの反応
耳たこ音読|金属イオンと塩基の反応
音声を再生して要点を音読しよう。耳たこになるまで、くり返し聞いて声に出すのが効果的!
ナレーション 音読さん
イオンは、塩基水溶液や少量の塩基には化合物の色沈殿を生じ、過剰な塩基には錯イオンの色溶液となる。
イオンは、塩基水溶液や少量の溶液には化合物の色沈殿を生じ、過剰な条件には錯イオンの色溶液となる。
イオンは、少量の塩基水溶液や塩基には化合物の色沈殿が生じ、過剰な塩基には錯イオンの色溶液となる。
イオンは、塩基水溶液や塩基には化合物の色沈殿を生じ、イオンは、塩基水溶液や塩基には化合物の色沈殿を生じる。
イオンは、少量の塩基水溶液や少量の塩基には化合物の色沈殿を生じ、過剰の塩基には錯イオンの色溶液、過剰の塩基には錯イオンの色溶液となる。
イオンは、少量の塩基水溶液や塩基には化合物の色沈殿が生じ、過剰な塩基には錯イオンの色溶液となる。
耳たこ音読|金属イオンの沈殿
音声を再生して要点を音読しよう。耳たこになるまで、くり返し聞いて声に出すのが効果的!
ナレーション 音読さん
化合物との反応では、すべての液性でイオン、イオン、イオンはそれぞれ化合物、化合物、化合物の色沈殿を生じる。また、液性および液性の溶液ではイオン、イオンは化合物の色沈殿を生じて、イオンは化合物の色沈殿を生じる。
酸との反応では、イオン、イオンはそれぞれ化合物、化合物の色沈殿を生じる。
酸との反応では、イオン、イオン、イオンはそれぞれ化合物、化合物、化合物の色沈殿を生じる。
イオンとの反応では、イオン、イオンはそれぞれ化合物、化合物の色沈殿を生じる。
イオンとの反応では、イオンは化合物の色沈殿を、イオンおよびイオンはそれぞれ化合物および化合物の色沈殿を生じる。
塩基との沈殿
Ag⁺
色・状態
色・状態
Cu²⁺
色・状態
色・状態
Pb²⁺
色・状態
色・状態
Fe²⁺
色・状態
Fe³⁺
色・状態
Zn²⁺
色・状態
色・状態
色・状態
Al³⁺
色・状態
色・状態
硫化水素・塩酸との沈殿
Ag⁺
Ag₂S 色・状態
AgCl
色・状態
Hg²⁺
HgS 色・状態
–
Cu²⁺
CuS 色・状態
×
Pb²⁺
PbS 色・状態
PbCl₂
色・状態
Cd²⁺
CdS 色・状態
–
Ni²⁺
×
NiS 色・状態
–
Fe²⁺
×
FeS 色・状態
×
Fe³⁺
–
FeS 色・状態
×
Zn²⁺
×
ZnS 色・状態
×
Mn²⁺
×
MnS 色・状態
–
硫酸・炭酸・クロム酸との沈殿
Ag⁺
×
–
Ag₂CrO₄ 色・状態
Pb²⁺
PbSO₄ 色・状態
–
PbCrO₄ 色・状態
Ca²⁺
CaSO₄ 色・状態
CaCO₃ 色・状態
×
Ba²⁺
BaSO₄ 色・状態
BaCO₃ 色・状態
BaCrO₄ 色・状態
炎色反応
Li⁺
炎色反応
Ca²⁺
炎色反応
Na⁺
炎色反応
Sr²⁺
炎色反応
K⁺
炎色反応
Ba²⁺
炎色反応
Cu²⁺
炎色反応
金属イオンの分類
耳たこ音読|金属イオンの分離
音声を再生して要点を音読しよう。耳たこになるまで、くり返し聞いて声に出すのが効果的!
ナレーション 音読さん
ナトリウムイオンNa⁺、カルシウムイオンCa²⁺、アルミニウムイオンAl³⁺、鉄(Ⅲ)イオンFe³⁺、亜鉛イオンZn²⁺、鉛イオンPb²⁺、銅イオンCu²⁺、銀イオンAg⁺を含む混合溶液を分離していく。
酸を加えると、イオンとイオンがそれぞれ生成物と生成物の色沈殿として生じる。これに条件を加えると化合物が溶けて色溶液となる。
液性溶液となるので試薬を通じると、イオンが生成物の色沈殿を生じる。また、イオンがイオンに還元される。
加熱して物質名を蒸発させて酸を加えると、イオンがイオンに酸化する。
溶液を加えるとイオンが生成物の色沈殿、イオンが生成物の色沈殿として生じる。
これに過剰な塩基を加えると、イオンが錯イオンの色溶液となる。
液性溶液となるので試薬を通じると、イオンが生成物の色沈殿として生じる。
加熱して物質名を蒸発させて溶液を加えると、イオンが生成物の色沈殿として生じる。
水溶液中にイオンが残るので、検出法で色になるかを確認する。
系統分離
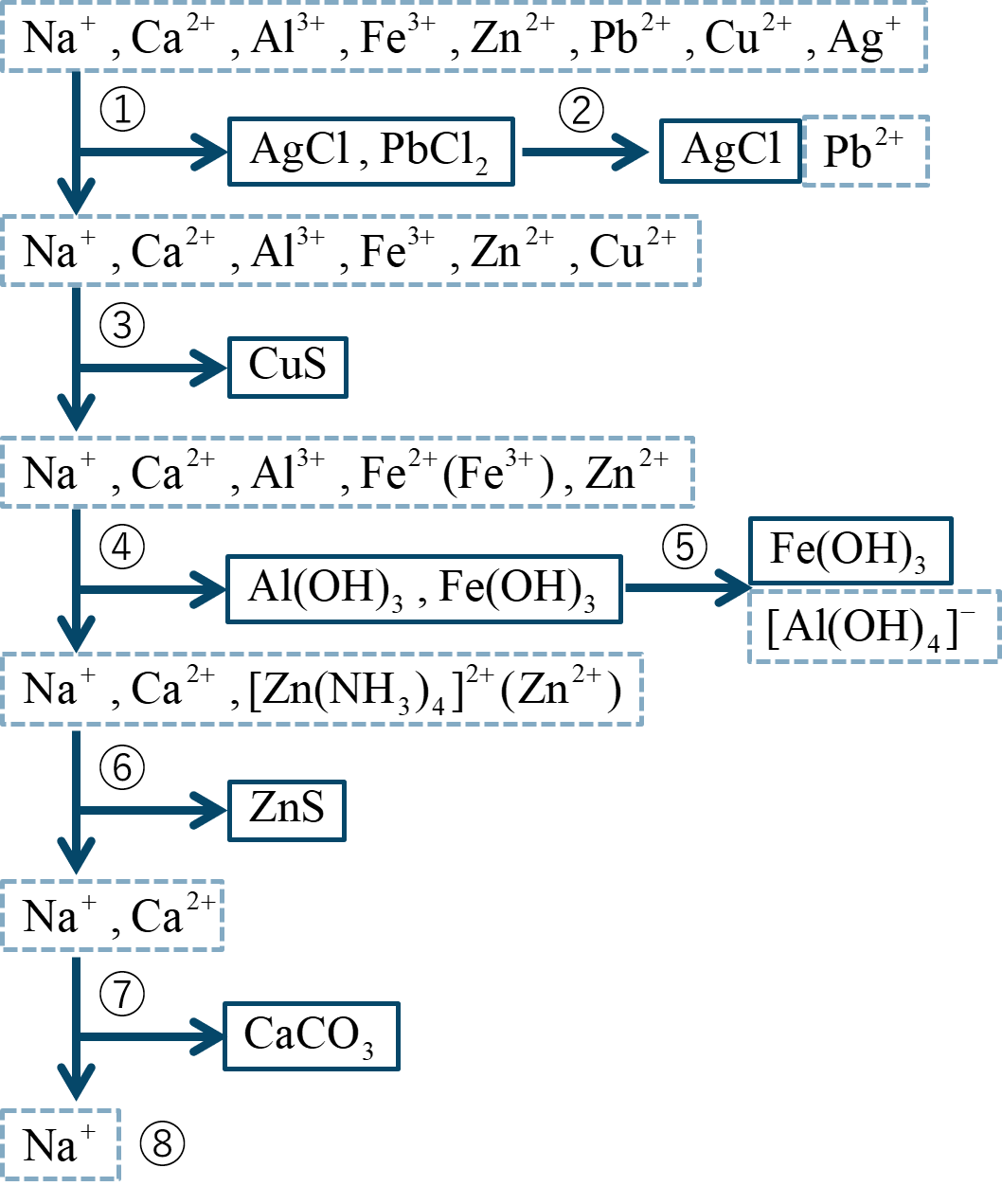
→ Pb²⁺、Ag⁺ を分離
→ Pb²⁺ と Ag⁺ を区別
→ Fe³⁺ が Fe²⁺ として、Cu²⁺ を分離
物質名(酸) を加えて Fe²⁺ → Fe³⁺ とする。
物質名 を加えると、色 の 化合物 と 色 の 化合物 が沈殿する。
→ Al³⁺、Fe³⁺ を分離
→ Al³⁺ と Fe³⁺ を区別
→ Zn²⁺ を分離
化合物 (NH₄)₂CO₃ を加えると、色 の 化合物 が沈殿する。
→ Ca²⁺ を分離
→ Na⁺ を確認 炎色反応
Cu²⁺ → Hg²⁺やCd²⁺、Zn²⁺ → Ni²⁺やMn²⁺、
Ca²⁺ → Sr²⁺やBa²⁺、Na⁺ → K⁺
これらを用いることがある。




