- 耳たこ無機化学「アルカリ金属」の暗記ページです。
- 四角い枠をクリックすると解答が表示され、下のボタンで一括表示・非表示の切替ができます。
- 耳たこ音読では音声ファイルを再生して要点を音読します。通学時間などのスキマ学習に最適です。
- 目次をクリックすると各セクションへ移動します。
アルカリ金属
耳たこ音読|アルカリ金属元素
音声を再生して要点を音読しよう。耳たこになるまで、くり返し聞いて声に出すのが効果的!
ナレーション 音読さん
元素を除く数族元素の元素、元素、元素などを分類名という。単体は、塩化物の製法で得られる。銀白色の分類名で、密度が大小融点が高低性質。イオン化傾向が大きく、価数とイオンになりやすい。また、○○性が強く、常温で物質と激しく反応して生成物となり、液性を示す。反応性が強いので物質中に保存する。炎色反応を示し、リチウムは色、ナトリウムは色、カリウムは色を示す。
耳たこ音読|ナトリウムの化合物
音声を再生して要点を音読しよう。耳たこになるまで、くり返し聞いて声に出すのが効果的!
ナレーション 音読さん
化合物は、色の状態で水に溶けやすさ液性を示す。○○性がある。化合物を吸収して化合物となる。製法は、溶液の方法で得られる。
化合物は、色の粉末で水に溶けやすさ液性を示す。化合物は○○性を示す。酸と反応して弱酸の用語が起こり、化合物を発生する。製法は、製法名。
化合物は、色の粉末で水に溶けて液性を示す。別名とも呼ばれ、胃の用途や用途に用いる。酸と反応して弱酸の用語が起こり、化合物を発生する。操作すると化合物となり化合物を発生する。
耳たこ音読|アンモニアソーダ法
音声を再生して要点を音読しよう。耳たこになるまで、くり返し聞いて声に出すのが効果的!
ナレーション 音読さん
化合物の工業的製法は、製法名という。化合物の飽和水溶液に化合物を加えて、化合物を通じると、化合物と化合物が得られる。この物質名を加熱すると、物質名が得られる。
鉱物名(化合物)を熱分解すると、化合物と化合物となり、二酸化炭素は再利用される。
物質名に水を加えると化合物となり、化合物を加えると化合物が遊離する。このアンモニアは再利用される。
全体の反応は、化合物と化合物から、化合物と副生成物として化合物が得られる。
アルカリ金属の性質
■ アルカリ金属の性質
② 単体は色の硬度。金属分類名と分類され、用語が低い。
③ 用語しやすいので物体中に保存。
④ 反応を示す。リチウムは炎色、ナトリウムは色、カリウムは色。
□ アルカリ金属の製法
単体は、◯◯物(塩化ナトリウムNaClなど)の別名で得られる。
□ アルカリ金属の反応
○○性や○○性が大きい。水と激しく反応して、単体を発生し用語となる。
■ アルカリ金属の水酸化物
ナトリウムの化合物
① 色・状態で、水に溶けやすさて、液性・強弱性を示す。
② 用語を用語する○○性がある。
③ 物質名と反応して物質名となる。
(式) 2NaOH + CO₂ → Na₂CO₃ + H₂O
□ 水酸化ナトリウムの製法
工業的製法は、物質名水溶液の用語で得られる。
(式) 2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂
■ 炭酸ナトリウムの性質
① 色・状態で、水に溶けやすさて、塩は液性性を示す。
② 用語Na₂CO₃・10H₂O は空気中で用語する。
③ 物体や物体の製造に用いる。
④ 液性の物質と反応して物質名を発生する。
(式) Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂
□ 炭酸ナトリウムの製法
工業的製法は、名称法で得られる。
■ 炭酸水素ナトリウムの性質
① 白色の粉末で、水に溶けやすさて、塩は液性性を示す。
② 胃の物体や物体に用いる。
③ 液性の物質と反応して物質名を発生する。
(式) NaHCO₃ + HCl → NaCl + H₂O + CO₂
④ 用語して物質名となり、物質名を発生する。
(式) 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
アンモニアソーダ法
原料として化合物と化合物を用いて、副生成物として化合物を得る。
また、②と⑤の反応で得られた化合物、物質名、化合物は回収され①の反応で用語される。
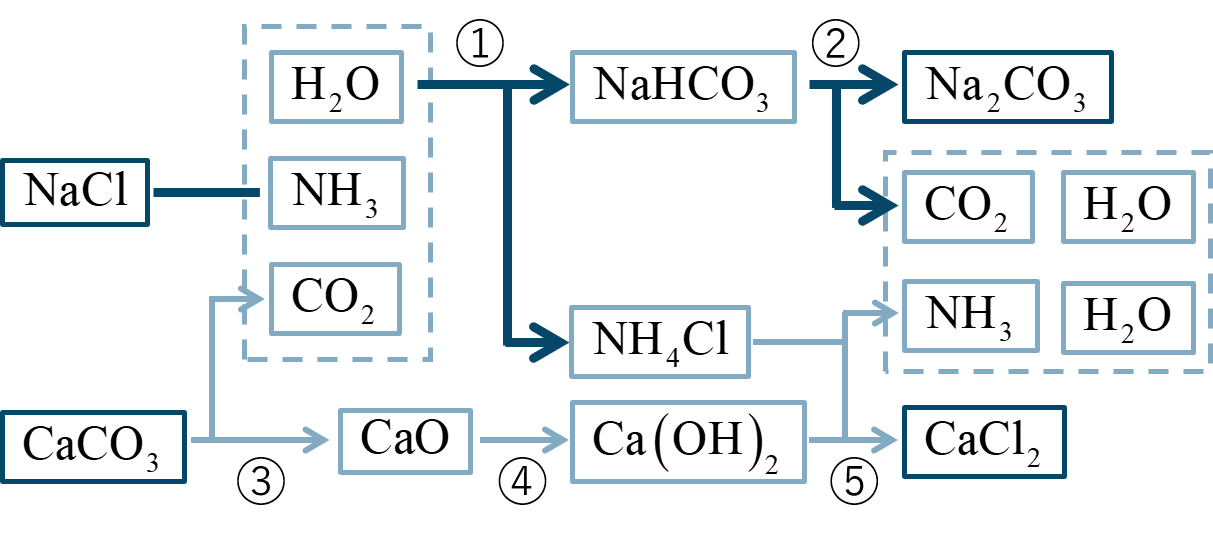
物体に、十分な化合物を加えて化合物を通じる。
(式) NaCl + NH₃ + CO₂ + H₂O
→ NaHCO₃ + NH₄Cl
② 主反応
化合物を用語する。
(式) 2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
③ 副反応
物質名=化合物を用語する。
(式) CaCO₃ → CaO + CO₂
④ 副反応
物質名=化合物に物質名を加える。
(式) CaO + H₂O → Ca(OH)₂
⑤ 副反応
化合物に物質名=化合物を加えて化合物を用語させる。
(式) 2NH₄Cl + Ca(OH)₂
→ CaCl₂ + 2NH₃ + 2H₂O
全体反応
2 mol の化合物に対して、1 mol の化合物が得られる。
(式) 2NaCl + CaCO₃ → Na₂CO₃ + CaCl₂
化学反応式演習|ナトリウムの反応
この単元の化学反応式の演習問題です。
[ 解答と解説を見る ]をクリックすると解答と解説が表示されます。
40 ナトリウムと水
ナトリウムに水を反応させる。
[ 解答と解説を見る ]
常温で激しく反応して水酸化ナトリウムが得られる。
2Na + 2H₂O → 2NaOH + H₂
41 水酸化ナトリウムと二酸化炭素
水酸化ナトリウムに二酸化炭素を反応させる。
[ 解答と解説を見る ]
二酸化炭素を吸収し、炭酸ナトリウムが得られる。
2NaOH + CO₂ → Na₂CO₃ + H₂O
42 塩化ナトリウム水溶液の電気分解
塩化ナトリウム水溶液を電気分解したときの反応。
[ 解答と解説を見る ]
水酸化ナトリウムの工業的製法。
2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂
43 炭酸ナトリウムと希塩酸
炭酸ナトリウムに希塩酸を加えたときの反応。
[ 解答と解説を見る ]
二酸化炭素が発生する。
Na₂CO₃ + 2HCl → 2NaCl + H₂O + CO₂
弱酸の炭酸塩の遊離反応。
44 炭酸水素ナトリウムと希塩酸
炭酸水素ナトリウムに希塩酸を加えたときの反応。
[ 解答と解説を見る ]
二酸化炭素が発生する。
NaHCO₃ + HCl → NaCl + H₂O + CO₂
弱酸の炭酸水素塩の遊離反応。
45 炭酸水素ナトリウムを熱分解
炭酸水素ナトリウムを熱分解するときの反応。
[ 解答と解説を見る ]
分解して炭酸ナトリウムが得られ、二酸化炭素が発生する。
2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
46 アンモニアソーダ法
アンモニアソーダ法の主反応2つ、副反応3つ、全体反応1つ。
[ 解答と解説を見る ]
① 主反応:飽和食塩水にアンモニアを加えて二酸化炭素を通じる。
NaCl + NH₃ + CO₂ + H₂O → NaHCO₃ + NH₄Cl
② 主反応:炭酸水素ナトリウムを加熱する。
2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
③ 副反応:石灰石を加熱する。
CaCO₃ → CaO + CO₂
④ 副反応:生石灰に水を加える。
CaO + H₂O → Ca(OH)₂
⑤ 副反応:塩化アンモニウムに消石灰を加えて、アンモニアを遊離させる。
2NH₄Cl + Ca(OH)₂ → CaCl₂ + 2NH₃ + 2H₂O
■全体反応
2NaCl + CaCO₃ → Na₂CO₃ + CaCl₂




