[ ] や表の空欄をクリックすると答えが表示されます。
また、ページをリロード(再読み込み)またはページを移動すると再度空欄になるので、何度も繰り返して暗記していきましょう!
分子の極性
電気陰性度
| ・電気陰性度 | |
| 説 明 |
共有結合している原子間で、[ 用語 ] を引きつける強さを数値にしたものを [ 用語 ] という。貴ガスを除いた周期表の右上ほど強くなり、[ 元素 ] が最大。 |
二原子分子の極性
| ・同種の原子間 H – H | |
| 説 明 |
[ 用語 ] の差がないので極性はない。 |
| ・異種の原子間 H – Cl | |
| 説 明 |
電気陰性度の大きい原子に [ 用語 ] が偏り、その差が大きいほど [ 用語 ] も大きい。 共有電子対が偏った原子が [ 用語 ] を帯びて、もう片方の原子は正の電荷を帯びる。 |
多原子分子の極性
| 多原子分子では [ 用語 ] が分子の極性に影響する。無極性分子は、[ 用語 ] を打ち消し合う構造をしている。 | |
| 無極性分子 | 水素 H₂ [ 分子の形 ] |
二酸化炭素 CO₂ [ 分子の形 ] |
|
メタン CH₄ [ 分子の形 ]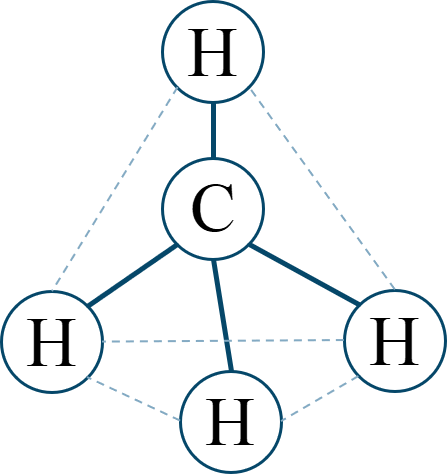 |
|
| 極性分子 | 塩化水素 HCl [ 用語 ] |
水 [ 分子の形 ]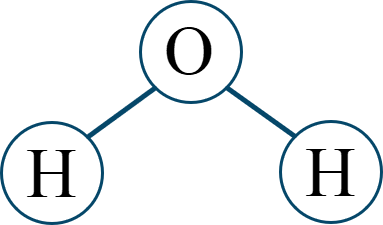 |
|
アンモニア [ 分子の形 ]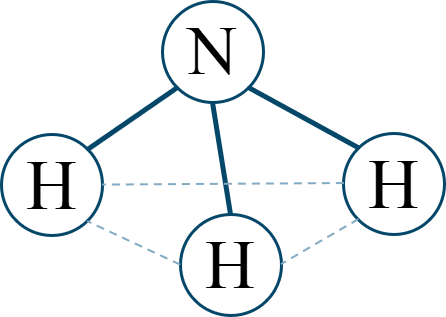 |
|
次のページ「【発展】分子間力」


